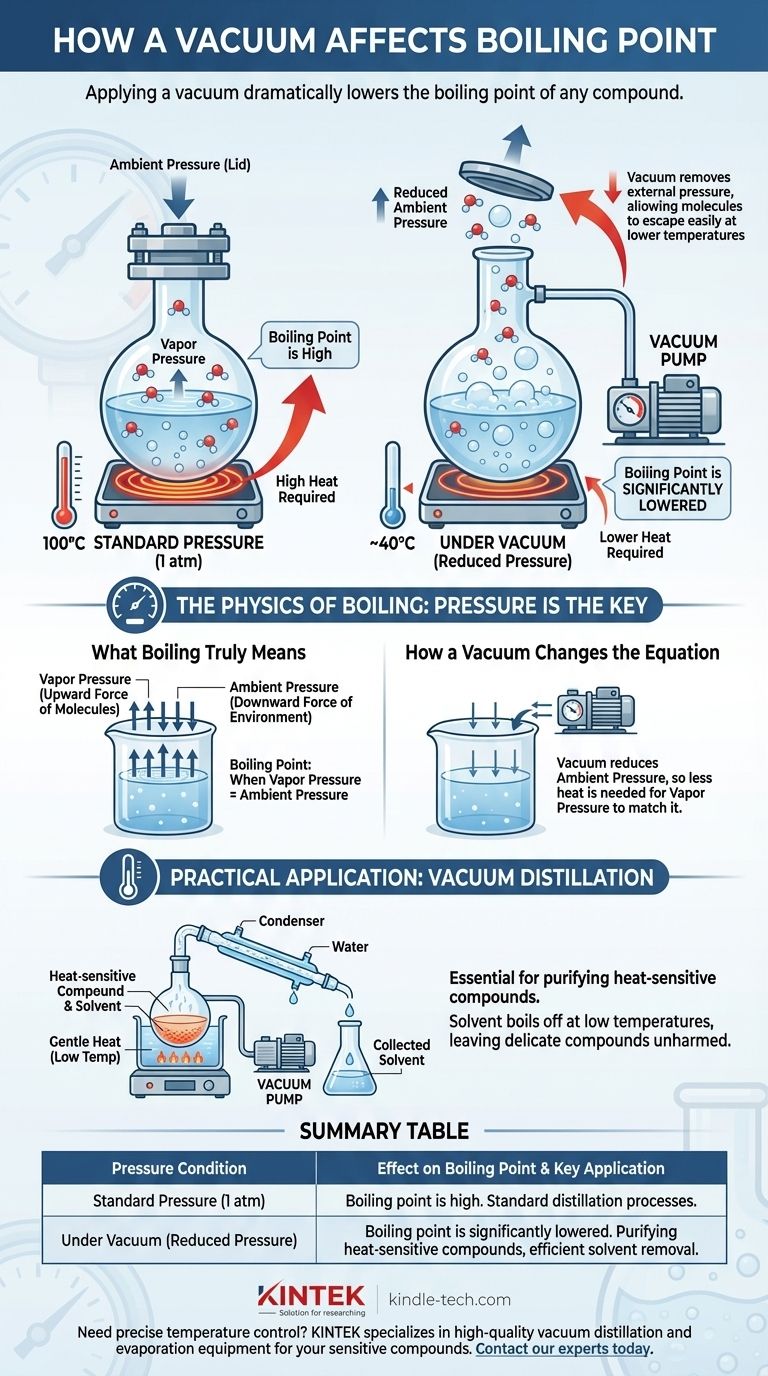
باختصار، يؤدي تطبيق الفراغ إلى خفض نقطة غليان أي مركب بشكل كبير. الغليان ليس درجة حرارة ثابتة، بل هو النقطة التي يتساوى فيها ضغط البخار الداخلي للسائل مع الضغط الخارجي الذي يضغط على سطحه. من خلال خلق فراغ، فإنك تزيل هذا الضغط الخارجي، مما يسهل على الجزيئات الهروب من الطور السائل والتحول إلى غاز عند درجة حرارة أقل بكثير.
نقطة غليان السائل ليست ثابتة؛ إنها دالة مباشرة للضغط المحيط. يؤدي تقليل هذا الضغط باستخدام الفراغ إلى خفض الطاقة المطلوبة لانتقال الجزيئات إلى غاز، مما يتسبب في غليان المادة عند درجة حرارة منخفضة بشكل كبير.

فيزياء الغليان: الضغط هو المفتاح
لفهم سبب تأثير الفراغ القوي، يجب علينا أولاً إعادة تعريف ما هو "الغليان" بالفعل. إنه أقل عن درجة حرارة محددة وأكثر عن معركة الضغوط.
ماذا يعني الغليان حقًا
الغليان هو الحالة الفيزيائية المحددة حيث يصبح ضغط بخار السائل مساويًا للضغط المحيط ببيئته.
عند نقطة التوازن هذه، يمكن أن تتشكل فقاعات البخار داخل كتلة السائل وتصعد إلى السطح. هذا يختلف جوهريًا عن التبخر البسيط، الذي يحدث فقط على سطح السائل.
دور ضغط البخار
كل سائل يمارس ضغط بخار معين، وهو القوة الكامنة لجزيئاته التي تحاول الهروب إلى الطور الغازي.
عند تسخين سائل، تكتسب جزيئاته طاقة حركية. تسبب هذه الطاقة المتزايدة في دفعها بقوة أكبر ضد محيطها، وبالتالي، يزداد ضغط البخار مع درجة الحرارة.
كيف يعمل الضغط المحيط كـ "غطاء"
يفرض الغلاف الجوي من حولنا ضغطًا ثابتًا على كل شيء، بما في ذلك سطح السوائل. يمكنك التفكير في هذا الضغط المحيط كـ "غطاء" مادي يحافظ على جزيئات السائل في مكانها.
لكي يغلي السائل، يجب أن يصبح ضغط بخاره قويًا بما يكفي "لرفع الغطاء". عند مستوى سطح البحر (ضغط جوي واحد)، يجب أن يصل الماء إلى 100 درجة مئوية (212 درجة فهرنهايت) لتوليد ضغط بخار كافٍ لتحقيق ذلك.
كيف يغير الفراغ المعادلة
تعمل مضخة التفريغ عن طريق إزالة جزيئات الغاز من نظام محكم الإغلاق، وبالتالي تقليل الضغط المحيط بشكل كبير. هذا يغير بشكل أساسي الظروف المطلوبة للغليان.
إزالة "الغطاء"
تطبيق الفراغ يعادل رفع "غطاء" الضغط هذا. مع وجود عدد أقل من جزيئات الغاز التي تضغط على سطح السائل، يمكن للجزيئات الهروب بسهولة أكبر بكثير.
هذا هو نفس السبب الذي يجعل الماء يغلي عند درجة حرارة أقل في الارتفاعات العالية. يكون الضغط الجوي أقل على الجبل، لذا يلزم حرارة أقل ليتساوى ضغط بخار الماء معه.
نقطة الغليان الجديدة، الأقل
نظرًا لأن الضغط الخارجي أصبح الآن أقل بكثير، فإن السائل لا يحتاج إلى نفس القدر من الطاقة الحرارية لبناء ضغط بخاره إلى نقطة الغليان.
والنتيجة هي أن المادة ستغلي عند درجة حرارة أقل بكثير من نقطة غليانها القياسية. على سبيل المثال، تحت فراغ قوي بما فيه الكفاية، يمكن جعل الماء يغلي في درجة حرارة الغرفة.
التطبيق العملي: التقطير الفراغي
هذا المبدأ ضروري في الكيمياء لتنقية المركبات الحساسة للحرارة. يمكن للكيميائي وضع خليط تحت فراغ وتسخينه بلطف.
سيغلي المذيب المتطاير عند درجة حرارة منخفضة جدًا، تاركًا وراءه المركب المطلوب، الأكثر حساسية، والذي لا يتعرض أبدًا لحرارة عالية قد تكون ضارة.
فهم المقايضات والمخاطر
على الرغم من قوته، فإن استخدام الفراغ لخفض نقطة الغليان لا يخلو من التحديات ويتطلب دراسة متأنية.
خطر "الارتداد"
تحت التفريغ، يمكن أن تغلي السوائل بشكل متفجر في ظاهرة تسمى الارتداد. يمكن أن يتسبب التسخين غير المتساوي في تسخين جزء من السائل بشكل مفرط، مما يتحول فجأة إلى بخار بقوة عنيفة. يتم التحكم في ذلك عادةً باستخدام رقائق الغليان أو التحريك المستمر.
صعوبة مع المواد منخفضة التطاير
بالنسبة للمواد ذات القوى الجزيئية الضعيفة جدًا وبالتالي ضغوط البخار المنخفضة جدًا (مثل الزيوت أو السوائل الأيونية)، قد لا يخفض الفراغ العالي نقطة الغليان بما يكفي لمنع التحلل الحراري. هناك حد عملي لفائدة هذه التقنية.
المعدات وسلامة الختم
يتطلب تحقيق والحفاظ على فراغ عميق مضخات متخصصة وأواني زجاجية أو حاويات محكمة الإغلاق تمامًا. حتى التسرب الطفيف يمكن أن يعرض ضغط النظام للخطر، مما يتسبب في ارتفاع نقطة الغليان بشكل غير متوقع.
اتخاذ الخيار الصحيح لهدفك
التلاعب بالضغط هو أداة، ويعتمد تطبيقها كليًا على هدفك.
- إذا كان تركيزك الأساسي هو تنقية مركب حساس للحرارة: استخدم التقطير الفراغي لفصل المكونات عند درجات حرارة تمنع التحلل أو التفاعلات الجانبية غير المرغوب فيها.
- إذا كان تركيزك الأساسي هو إزالة المذيب بكفاءة: طبق فراغًا، غالبًا مع الدوران (كما هو الحال في المبخر الدوار)، لتبخير المذيبات بسرعة دون الحاجة إلى حرارة عالية.
- إذا كان تركيزك الأساسي هو تجفيف مادة حساسة: استخدم فراغًا عميقًا لخفض نقطة غليان/تسامي الماء، مما يسمح بالتجفيف عند درجات حرارة منخفضة (التجفيف بالتجميد) الذي يحافظ على بنية المادة.
في النهاية، يمنحك فهم العلاقة بين الضغط ودرجة الحرارة تحكمًا دقيقًا في الحالة الفيزيائية للمادة.
جدول الملخص:
| حالة الضغط | التأثير على نقطة الغليان | التطبيق الرئيسي |
|---|---|---|
| الضغط القياسي (1 ضغط جوي) | نقطة الغليان تكون عند درجة حرارتها القياسية، العالية. | عمليات التقطير القياسية. |
| تحت التفريغ (ضغط منخفض) | تنخفض نقطة الغليان بشكل كبير. | تنقية المركبات الحساسة للحرارة، إزالة المذيبات بكفاءة. |
هل تحتاج إلى تحكم دقيق في درجة الحرارة لمركباتك الحساسة؟ تتخصص KINTEK في معدات التقطير والتبخير الفراغي عالية الجودة، بما في ذلك المبخرات الدوارة، المصممة لحماية موادك الدقيقة عن طريق خفض نقاط الغليان. تضمن معداتنا المختبرية معالجة فعالة وآمنة للباحثين والمتخصصين في المختبرات. اتصل بخبرائنا اليوم للعثور على حل الفراغ المثالي لتطبيقك!
دليل مرئي
المنتجات ذات الصلة
- مضخة تفريغ مياه متداولة للاستخدام المختبري والصناعي
- مضخة تفريغ دوارة ذات ريش للمختبر للاستخدام المعملي
- مضخة تفريغ غشائية خالية من الزيت للاستخدام المخبري والصناعي
- مكبس حراري هيدروليكي كهربائي بالتفريغ للمختبر
- صمام كروي فراغي من الفولاذ المقاوم للصدأ 304 316 صمام توقف لأنظمة التفريغ العالي
يسأل الناس أيضًا
- ما هي مخاطر التلبيد؟ إدارة الدقة الأبعاد والتكاليف والامتثال
- ما هي المنتجات التي تخضع للتخمير؟ دليل للمعادن التي تتطلب "إعادة ضبط" حرارية
- كم تبلغ تكلفة فرن لمنزل بمساحة 1000 قدم مربع؟ دليل مفصل للتكلفة والحجم
- ما هي الخصائص التي تتأثر بالمعالجة الحرارية؟ دليل إلى الصلابة والقوة والمتانة
- ما هو معدل إحكام التسرب؟ قيّم أداء إحكامك
- لماذا يعتبر التفريغ (الفراغ) مهمًا لترسيب الأغشية الرقيقة؟ المفتاح إلى النقاء والتحكم في طلاء الأغشية الرقيقة
- ما مدى سخونة فرن المختبر؟ اختر تقنية التسخين المناسبة لتطبيقك
- كيف تؤثر درجة حرارة التلبيد على حجم الحبيبات؟ تحكم في البنية المجهرية لمادتك للحصول على خصائص مثالية



















