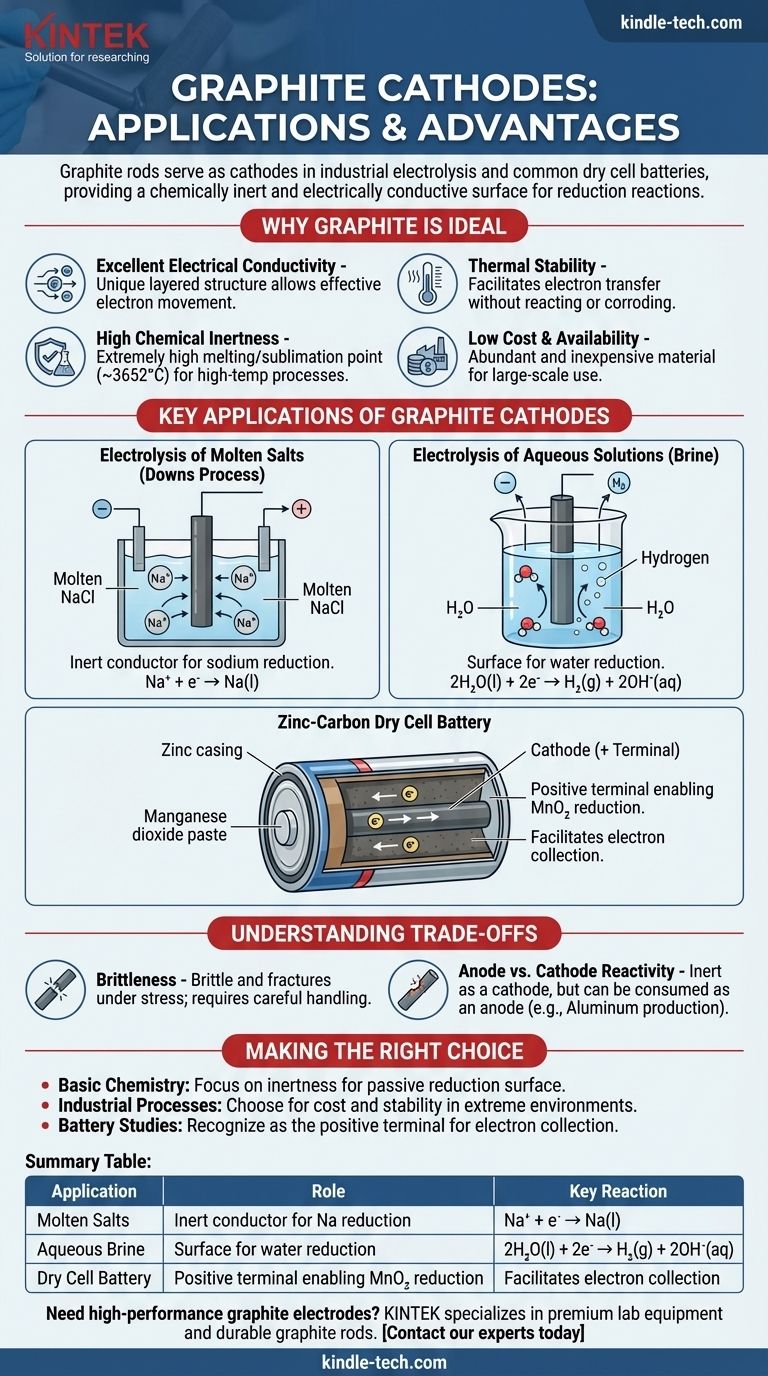
تعمل قضبان الجرافيت ككاثودات في العديد من العمليات الكهروكيميائية الرئيسية، وأبرزها التحليل الكهربائي الصناعي للأملاح وداخل بطاريات الخلايا الجافة الشائعة. في هذه التطبيقات، لا تتمثل الوظيفة الأساسية لقضيب الجرافيت في أن يستهلك أو يتفاعل، بل في أن يعمل كسطح خامل كيميائيًا وموصل للكهرباء حيث يمكن أن يحدث تفاعل اختزال.
يتم اختيار الجرافيت كمادة كاثود ليس لأنه يشارك في التفاعل الأساسي، ولكن لأنه موصل خامل ممتاز. إن مزيجه الفريد من الموصلية الكهربائية، والمقاومة الكيميائية، والاستقرار الحراري العالي، والتكلفة المنخفضة يجعله منصة مثالية لحدوث تفاعل الاختزال النصفي.

لماذا يعتبر الجرافيت مادة كاثود مثالية
يعد اختيار مادة للقطب الكهربائي خيارًا تصميميًا حاسمًا في أي خلية كهروكيميائية. يمتلك الجرافيت (شكل معين من الكربون) مجموعة من الخصائص التي تجعله مناسبًا بشكل استثنائي لدور الكاثود.
موصلية كهربائية ممتازة
يحتوي الجرافيت على بنية طبقية فريدة ومستوية. داخل هذه الطبقات، تكون الإلكترونات غير المتمركزة حرة في الحركة، مما يسمح للجرافيت بتوصيل الكهرباء بفعالية كبيرة، وهي سمة ضرورية لأي قطب كهربائي.
خمول كيميائي عالي
ككاثود، يجب أن يسهل القطب الكهربائي نقل الإلكترونات إلى مادة في الإلكتروليت دون أن يتفاعل هو نفسه. الكربون غير تفاعلي نسبيًا، خاصة مقارنة بمعظم المعادن، مما يعني أنه لن يتآكل أو يتداخل مع العملية الكيميائية المطلوبة.
الاستقرار الحراري
يمتلك الجرافيت واحدة من أعلى نقاط الانصهار/التسامي بين جميع العناصر (حوالي 3652 درجة مئوية أو 6606 درجة فهرنهايت). وهذا يجعله مثاليًا للعمليات الكهروكيميائية ذات درجة الحرارة العالية، مثل التحليل الكهربائي للأملاح المنصهرة، حيث ستذوب الأقطاب المعدنية.
تكلفة منخفضة وتوفر
من منظور صناعي، الجرافيت مادة وفيرة وغير مكلفة. وهذا يجعل الإنتاج الكهروكيميائي على نطاق واسع، والذي يتطلب أقطابًا كهربائية كبيرة، مجديًا اقتصاديًا.
تطبيقات رئيسية لكاثودات الجرافيت
يؤدي فهم حالات الاستخدام المحددة إلى توضيح النظرية. في كل مثال، يكون كاثود الجرافيت ببساطة هو الموقع الذي يتم فيه توصيل الإلكترونات لإحداث تغيير كيميائي.
التحليل الكهربائي للأملاح المنصهرة (عملية داونز)
في إنتاج فلز الصوديوم النقي من كلوريد الصوديوم المنصهر (NaCl)، غالبًا ما يستخدم قضيب الجرافيت ككاثود. تنجذب أيونات الصوديوم المشحونة إيجابًا (Na⁺) إلى الكاثود المشحون سلبًا، حيث تكتسب إلكترونًا وتختزل إلى فلز الصوديوم السائل.
Na⁺ + e⁻ → Na(l)
يوفر كاثود الجرافيت السطح والإلكترونات لهذا التفاعل فقط.
التحليل الكهربائي للمحاليل المائية (محلول ملحي)
عند التحليل الكهربائي لمحلول مائي من كلوريد الصوديوم (محلول ملحي)، يلعب كاثود الجرافيت دورًا مشابهًا. ومع ذلك، في هذه الحالة، يكون الماء أسهل في الاختزال من أيونات الصوديوم.
لذلك، تختزل جزيئات الماء على سطح كاثود الجرافيت، منتجة غاز الهيدروجين وأيونات الهيدروكسيد.
2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq)
بطارية الخلية الجافة من الزنك والكربون
في البطارية الشائعة "للخدمة الشاقة"، يكون القضيب المركزي مصنوعًا من الجرافيت ويعمل ككاثود (الطرف الموجب). وهو محاط بمعجون رطب من ثاني أكسيد المنجنيز (MnO₂) ومواد كيميائية أخرى.
يجمع قضيب الجرافيت الإلكترونات من الدائرة الخارجية. يحدث تفاعل الاختزال في المعجون المجاور للقضيب، حيث يتم اختزال ثاني أكسيد المنجنيز. الجرافيت يسهل هذه العملية ببساطة.
فهم المفاضلات
على الرغم من فعاليته العالية، فإن الجرافيت ليس مادة مثالية. إن إدراك حدوده هو المفتاح لفهم تطبيقاته.
التقصف
على عكس المعادن، التي تكون مطيلية، فإن الجرافيت هش ويمكن أن يتكسر تحت الصدمة الميكانيكية أو الإجهاد. وهذا يتطلب معالجة ودعمًا دقيقين في التصميمات الصناعية.
تفاعلية الأنود مقابل الكاثود
بينما يكون الجرافيت خاملًا جدًا ككاثود، يمكن أن يستهلك عند استخدامه كأنود (موقع الأكسدة) في عمليات معينة. على سبيل المثال، في إنتاج الألومنيوم، يتفاعل أنود الكربون مع الأكسجين المنتج لتكوين غاز ثاني أكسيد الكربون ويُستهلك ببطء.
الخلط بين أنواع الخلايا
نقطة شائعة للخلط هي قطبية الأقطاب الكهربائية. الكاثود هو دائمًا موقع الاختزال، لكن علامته تتغير اعتمادًا على نوع الخلية.
- في خلية تحليل كهربائي (مثل التحليل الكهربائي للملح)، يكون الكاثود هو الطرف السالب.
- في خلية جلفانية (مثل البطارية)، يكون الكاثود هو الطرف الموجب.
اتخاذ الخيار الصحيح لهدفك
يحدد سبب سؤالك عن كاثودات الجرافيت الجانب الأكثر أهمية للتركيز عليه.
- إذا كان تركيزك الأساسي على الكيمياء الأساسية: تذكر أن الجرافيت موصل خامل، يوفر سطحًا سلبيًا لحدوث تفاعل اختزال دون أن يتفاعل هو نفسه.
- إذا كان تركيزك الأساسي على العمليات الصناعية: اختر الجرافيت لفعاليته من حيث التكلفة واستقراره الذي لا مثيل له في البيئات ذات درجة الحرارة العالية أو المسببة للتآكل حيث ستفشل معظم المعادن.
- إذا كان تركيزك الأساسي على دراسة البطاريات: أدرك أن قضيب الجرافيت في خلية الزنك والكربون يعمل كطرف موجب (كاثود)، ويعمل كمجمع للإلكترونات الذي يمكن اختزال المعجون الكيميائي المحيط.
في النهاية، فهم دور الجرافيت ككاثود يتعلق بإدراك قوة مادة خاملة وموصلة تمكن الكيمياء دون التدخل فيها.
جدول ملخص:
| التطبيق | دور كاثود الجرافيت | التفاعل الرئيسي |
|---|---|---|
| التحليل الكهربائي للأملاح المنصهرة (عملية داونز) | موصل خامل لاختزال الصوديوم | Na⁺ + e⁻ → Na(l) |
| التحليل الكهربائي للمحلول الملحي المائي | سطح لاختزال الماء | 2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq) |
| بطارية الخلية الجافة من الزنك والكربون | طرف موجب يمكّن اختزال MnO₂ | يسهل جمع الإلكترونات |
هل تحتاج إلى أقطاب جرافيت عالية الأداء لعملياتك الكهروكيميائية؟ تتخصص KINTEK في معدات ومستهلكات المختبرات المتميزة، بما في ذلك قضبان الجرافيت المتينة المصممة لتوصيل فائق واستقرار حراري. سواء كنت تقوم بالتحليل الكهربائي الصناعي أو تطوير تقنيات البطاريات، فإن موادنا تضمن أداءً موثوقًا وخاملًا. اتصل بخبرائنا اليوم للعثور على حل الجرافيت المثالي لاحتياجات مختبرك!
دليل مرئي
المنتجات ذات الصلة
- لوح كربون جرافيت مصنّع بطريقة الضغط الأيزوستاتيكي
- مواد تلميع الأقطاب للتجارب الكهروكيميائية
- فرن تفحيم الجرافيت عالي الموصلية الحرارية
- فرن تفحيم الجرافيت الفراغي العمودي عالي الحرارة
- فرن جرافيت تسامي فراغي عمودي كبير
يسأل الناس أيضًا
- هل الجرافيت معدن موصل؟ اكتشف لماذا هذا اللافلز يشغل التقنيات الحديثة
- ما هي الأنواع الثلاثة للطلاء؟ دليل للطلاءات المعمارية والصناعية والخاصة
- ما هي خصائص الجرافيت؟ إطلاق العنان لقوة التوصيل والمقاومة في درجات الحرارة العالية
- ما هي مزايا الكتلة الحيوية؟ أطلق العنان للطاقة المتجددة من النفايات والمحاصيل
- ما هو الغرض من التغليف؟ حماية مستنداتك وتعزيزها للاستخدام طويل الأمد



















