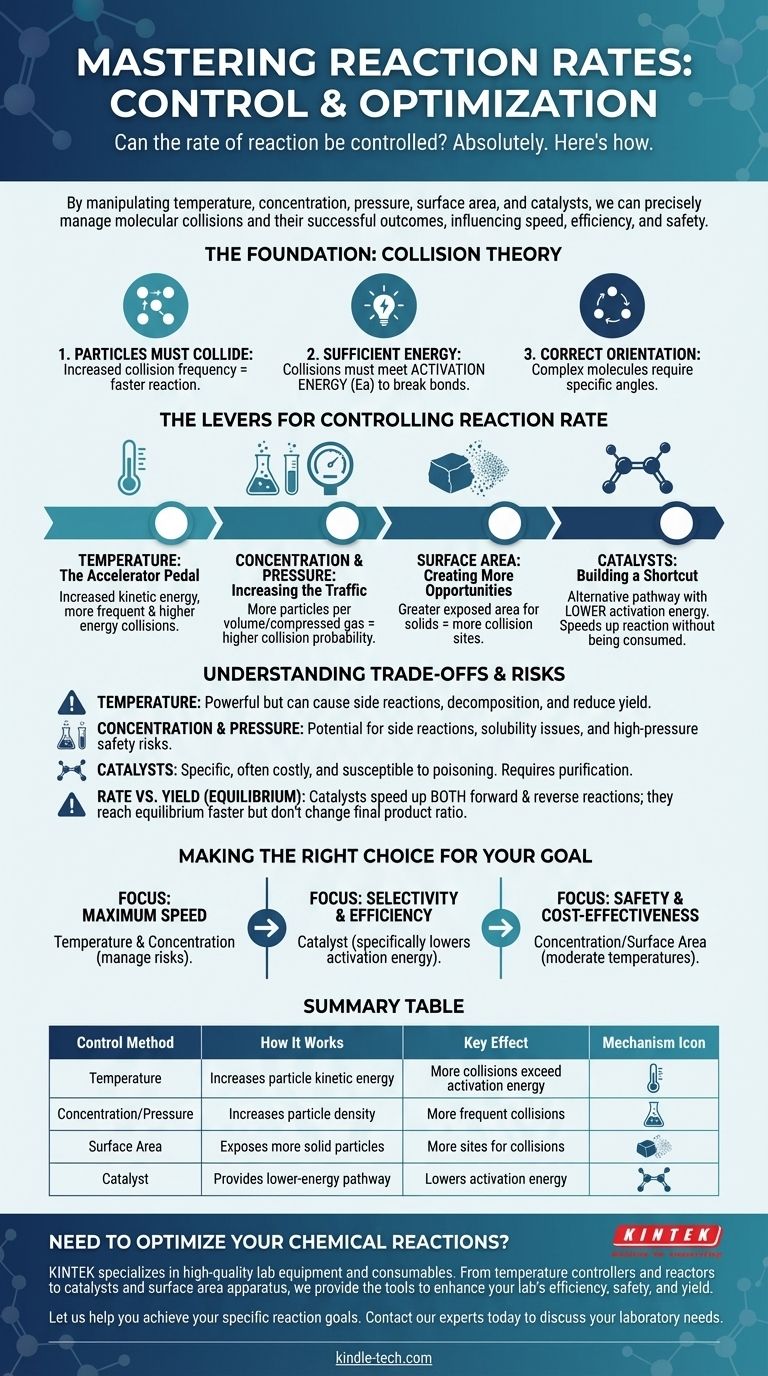
بالتأكيد. إن معدل التفاعل الكيميائي ليس خاصية ثابتة؛ بل يمكن التحكم فيه بدقة. من خلال معالجة العوامل الفيزيائية والكيميائية المحددة، يمكننا تسريع التفاعل أو إبطاؤه أو حتى إيقافه عمدًا. الروافع الأساسية لهذا التحكم هي درجة الحرارة، وتركيز المتفاعلات، والضغط (للغازات)، ومساحة السطح (للمواد الصلبة)، وإدخال المحفزات.
التحكم في معدل التفاعل يتعلق أساسًا بإدارة تكرار وطاقة التصادمات الجزيئية. كل طريقة، بدءًا من تسخين المادة إلى إضافة محفز، تعمل عن طريق التأثير على عدد مرات تصادم الجسيمات وما إذا كانت تلك التصادمات ناجحة.

الأساس: نظرية التصادم
للتحكم في التفاعل، يجب عليك أولاً فهم ما يجعله يحدث. يتم تنظيم معدل أي تفاعل من خلال مبادئ نظرية التصادم، التي تنص على وجوب استيفاء ثلاثة شروط لحدوث التفاعل.
1. يجب أن تتصادم الجسيمات
لكي يتفاعل جزيئان أو أكثر، يجب أن يتلامسا فيزيائيًا أولاً. كلما تكررت تصادم الجسيمات، زادت الفرص المتاحة لها للتفاعل، مما يزيد من معدل التفاعل.
2. يجب أن يكون للتصادمات طاقة كافية
التصادم وحده لا يكفي. يجب أن تمتلك الجسيمات المتصادمة الحد الأدنى من الطاقة الحركية المشتركة، والمعروفة باسم طاقة التنشيط (Ea). هذه الطاقة مطلوبة لكسر الروابط الكيميائية الموجودة حتى تتشكل روابط جديدة.
التصادمات التي تقل طاقتها عن طاقة التنشيط ستكون غير ناجحة؛ سوف ترتد الجسيمات عن بعضها البعض دون تغيير.
3. يجب أن يكون للجسيمات التوجيه الصحيح
بالنسبة للجزيئات المعقدة، يجب أن يحدث التصادم أيضًا بزاوية أو اتجاه محدد. إذا لم تتوافق الأجزاء التفاعلية من الجزيئات بشكل صحيح أثناء التصادم، فلن يحدث أي تفاعل، حتى لو تم تلبية متطلبات الطاقة.
روافع التحكم في معدل التفاعل
إن فهم نظرية التصادم يمنحنا خريطة طريق واضحة لمعالجة سرعة التفاعل. تعمل كل طريقة تحكم عن طريق تغيير شرط واحد أو أكثر مطلوب لتصادم ناجح.
درجة الحرارة: دواسة التسارع
تؤدي زيادة درجة الحرارة إلى رفع متوسط الطاقة الحركية للجسيمات. هذا له تأثير قوي ومزدوج.
أولاً، يتسبب في تحرك الجسيمات بشكل أسرع، مما يؤدي إلى تصادمات أكثر تكرارًا. ثانيًا، والأهم من ذلك، يعني أن نسبة أكبر بكثير من تلك التصادمات ستكون طاقتها مساوية لطاقة التنشيط أو أكبر منها، مما يزيد بشكل كبير من معدل التفاعلات الناجحة.
التركيز والضغط: زيادة حركة المرور
زيادة تركيز المتفاعلات في المحلول تعني وجود المزيد من الجسيمات المعبأة في نفس الحجم. وهذا يزيد بشكل مباشر من احتمالية التصادم، وبالتالي يرفع معدل التفاعل.
بالنسبة للغازات، فإن زيادة الضغط لها نفس التأثير. إنه يجبر جزيئات الغاز على الاقتراب من بعضها البعض، مما يزيد بشكل فعال من تركيزها ويؤدي إلى تصادمات أكثر تكرارًا.
مساحة السطح: خلق المزيد من الفرص
هذا العامل حاسم عندما يتفاعل مادة صلبة مع سائل أو غاز. عن طريق تكسير المادة الصلبة إلى قطع أصغر (على سبيل المثال، من كتلة صلبة إلى مسحوق)، فإنك تزيد بشكل كبير من مساحة السطح الإجمالية لها.
هذا يعرض المزيد من جسيمات المادة الصلبة للمتفاعل الآخر، مما يخلق المزيد من المواقع التي يمكن أن تحدث فيها التصادمات ويزيد من معدل التفاعل الإجمالي.
المحفزات: بناء طريق مختصر
المحفز هو مادة تزيد من معدل التفاعل دون أن تستهلك في هذه العملية. إنه يعمل عن طريق توفير مسار تفاعل بديل بطاقة تنشيط أقل.
المحفز لا يجعل الجسيمات تتصادم بشكل متكرر أو بطاقة أكبر. بدلاً من ذلك، فإنه يخفض "الحاجز" الطاقي الذي يجب أن يتغلب عليه التصادم ليكون ناجحًا، مما يسهل بكثير استمرار التفاعل.
فهم المفاضلات والمخاطر
في حين أن هذه الروافع فعالة، إلا أنها ليست خالية من العواقب. يتطلب اختيار الطريقة الصحيحة فهمًا لقيودها والجوانب السلبية المحتملة.
القوة الغاشمة لدرجة الحرارة
الحرارة أداة قوية ولكنها غير انتقائية. في حين أنها ستسرع التفاعل المطلوب، فإنها ستسرع أيضًا أي تفاعلات جانبية محتملة. وفي درجات الحرارة العالية جدًا، يمكن أن تتسبب حتى في تحلل المتفاعلات أو النواتج، مما يقلل من إنتاجك الإجمالي.
مخاطر التركيز والضغط
يمكن أن تؤدي التركيزات العالية أحيانًا إلى تفاعلات جانبية غير مرغوب فيها أو مشاكل في الذوبان. والأهم من ذلك، أن التشغيل تحت ضغوط عالية جدًا يتطلب معدات متخصصة ومكلفة وقوية لإدارة المخاطر الكبيرة المتمثلة في فشل الاحتواء المحتمل.
خصوصية المحفزات وتكلفتها
غالبًا ما تكون المحفزات محددة للغاية ويمكن أن تكون باهظة الثمن (على سبيل المثال، تلك التي تستخدم البلاتين أو البلاديوم). ويمكن أيضًا أن تصبح عديمة الفائدة بسبب الشوائب، وهي عملية تُعرف باسم تسمم المحفز، والتي تتطلب تنقية دقيقة للمتفاعلات.
المعدل مقابل المردود (الاتزان)
من الضروري التمييز بين معدل التفاعل ومردود التفاعل. بالنسبة للتفاعلات العكسية، التي يمكن أن تحدث في الاتجاهين الأمامي والعكسي، يسرّع المحفز من كلا التفاعلين بالتساوي. وهذا يعني أنك ستصل إلى الاتزان بشكل أسرع، لكنه لن يغير النسبة النهائية للمنتجات إلى المتفاعلات.
اتخاذ الخيار الصحيح لهدفك
تعتمد الاستراتيجية المثلى للتحكم في التفاعل بالكامل على هدفك المحدد، سواء كان السرعة أو الكفاءة أو السلامة.
- إذا كان تركيزك الأساسي هو أقصى سرعة: فإن زيادة درجة الحرارة والتركيز هما أدواتك الأكثر مباشرة، ولكن يجب عليك إدارة مخاطر التفاعلات الجانبية والمخاطر المتعلقة بالسلامة بنشاط.
- إذا كان تركيزك الأساسي هو الانتقائية والكفاءة: فغالبًا ما يكون المحفز هو الخيار الأفضل، حيث يمكنه تحديدًا خفض طاقة التنشيط للتفاعل المطلوب دون تعزيز التفاعلات الأخرى.
- إذا كان تركيزك الأساسي هو السلامة والفعالية من حيث التكلفة: فإن معالجة التركيز أو مساحة السطح في درجات حرارة معتدلة غالبًا ما تكون الطرق الأكثر سهولة والأقل خطورة.
إتقان هذه العوامل يسمح لك بتحويل التفاعلات الكيميائية من أحداث ثابتة إلى عمليات ديناميكية يمكن توجيهها بدقة لتحقيق نتيجة محددة.
جدول الملخص:
| طريقة التحكم | كيف تعمل | التأثير الرئيسي |
|---|---|---|
| درجة الحرارة | تزيد من الطاقة الحركية للجسيمات | يتجاوز عدد أكبر من التصادمات طاقة التنشيط |
| التركيز/الضغط | يزيد من كثافة الجسيمات | تصادمات أكثر تكرارًا |
| مساحة السطح | يكشف عن المزيد من جسيمات المادة الصلبة المتفاعلة | مزيد من المواقع للتصادمات |
| المحفز | يوفر مسار تفاعل بطاقة أقل | يخفض طاقة التنشيط |
هل تحتاج إلى تحسين تفاعلاتك الكيميائية؟
يعد التحكم الدقيق في معدلات التفاعل أمرًا أساسيًا لنجاح العمل المخبري. سواء كنت بحاجة إلى تسريع عملية تخليق، أو تحسين الانتقائية، أو ضمان التشغيل الآمن، فإن المعدات المناسبة ضرورية.
تتخصص KINTEK في توفير معدات ومواد استهلاكية مخبرية عالية الجودة لمساعدتك في إتقان هذه المتغيرات. بدءًا من أجهزة التحكم في درجة الحرارة والمفاعلات الدقيقة لإدارة الحرارة والضغط، وصولًا إلى مجموعة واسعة من المحفزات والأجهزة المصممة للتفاعل الأمثل لمساحة السطح، لدينا الأدوات اللازمة لتعزيز كفاءة مختبرك وسلامته ومردوده.
دعنا نساعدك في تحقيق أهداف التفاعل المحددة الخاصة بك. اتصل بخبرائنا اليوم لمناقشة احتياجات مختبرك والعثور على الحل المثالي.
دليل مرئي
المنتجات ذات الصلة
- مفاعلات الضغط العالي القابلة للتخصيص للتطبيقات العلمية والصناعية المتقدمة
- مفاعلات مختبرية قابلة للتخصيص لدرجات الحرارة العالية والضغط العالي لتطبيقات علمية متنوعة
- مفاعل مفاعل عالي الضغط صغير من الفولاذ المقاوم للصدأ للاستخدام المخبري
- مفاعل الأوتوكلاف عالي الضغط للمختبرات للتخليق المائي الحراري
- محطة عمل الضغط المتساوي الحراري الرطب WIP 300 ميجا باسكال للتطبيقات عالية الضغط
يسأل الناس أيضًا
- ما هو دور المفاعلات عالية الضغط في دراسة أكسدة السبائك؟ أدوات أساسية للبحث فوق الحرج
- ما هي الأدوار التي تلعبها الأفران الأوتوكلافية في تخليق الزيوليت من نوع MFI؟ إتقان نمو البلورات الحرارية المائية
- ما هي وظيفة مفاعل التخليق المائي ذو درجة الحرارة الثابتة؟ إتقان تنشيط رماد الفحم المتطاير
- كيف يثبت مفاعل الضغط العالي قيمته في الشيخوخة المتسارعة؟ توقع متانة المحفز بسرعة
- ما هو الغرض من استخدام مفاعل التخليق الحراري المائي عالي الحرارة؟ تعزيز تخليق الكاثود اليود@الكربون المنشط



















