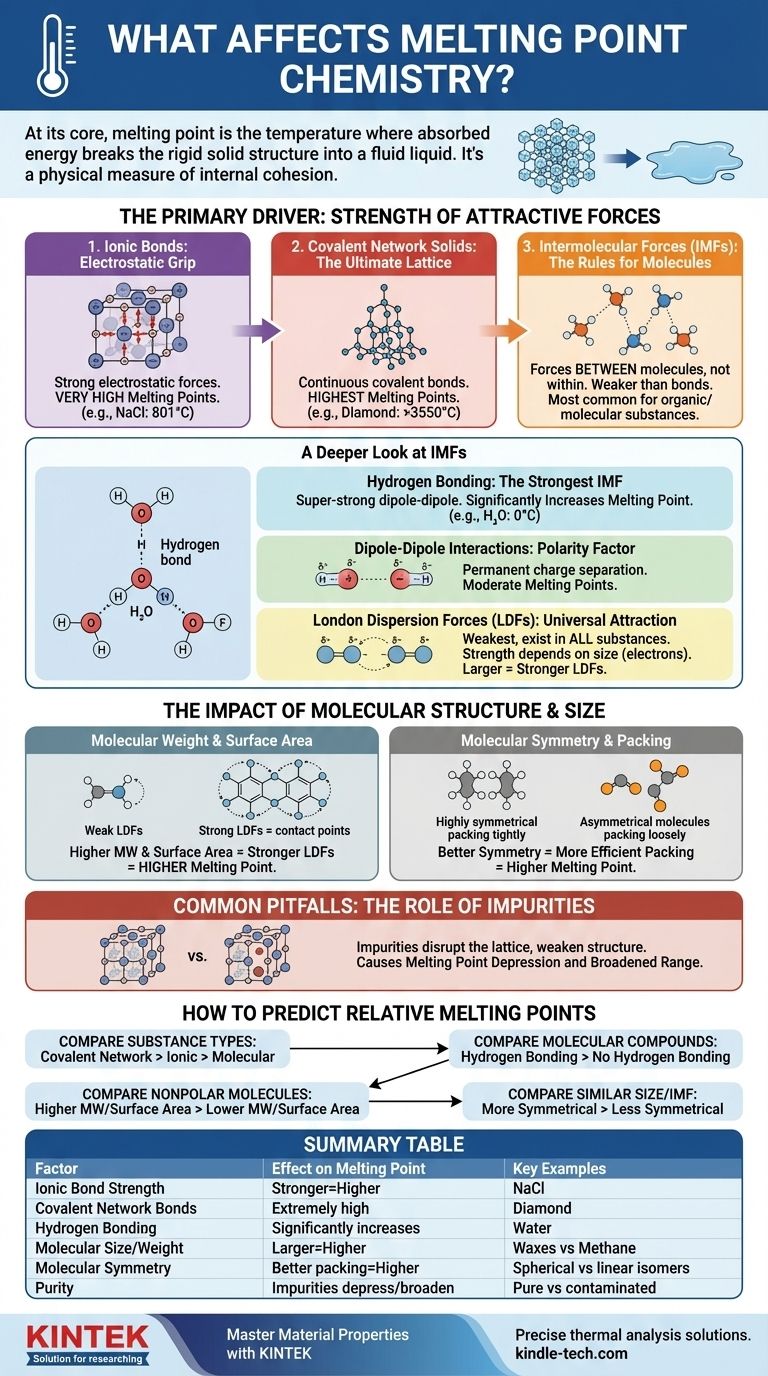
في جوهرها، درجة انصهار المادة هي درجة الحرارة التي تكون عندها المادة قد امتصت طاقة كافية لكسر التركيب الصلب والمنظم للمادة الصلبة والانتقال إلى سائل غير منظم ومائع. يتم تحديد ذلك من خلال عاملين أساسيين: قوة قوى الجذب التي تربط الجسيمات (الذرات أو الأيونات أو الجزيئات) معًا، والكفاءة التي تتراص بها تلك الجسيمات في شبكة بلورية صلبة.
درجة الانصهار ليست مجرد رقم؛ إنها مقياس مادي للتماسك الداخلي للمادة. لفهمها، يجب عليك أولاً تحديد القوة المهيمنة التي تربط الجسيمات معًا - سواء كانت رابطة أيونية قوية أو جاذبية بين جزيئية ضعيفة - ثم النظر في كيفية قيام حجم وشكل الجزيء بتنقيح هذه القيمة.

المحرك الأساسي: قوة قوى الجذب
كمية الطاقة اللازمة لتعطيل الشبكة البلورية تتناسب طرديًا مع قوة القوى التي تربطها معًا. توجد هذه القوى على طيف واسع، من الروابط الكيميائية القوية بشكل لا يصدق إلى القوى الأضعف بين الجزيئات.
الروابط الأيونية: القبضة الكهروستاتيكية
المركبات الأيونية، مثل ملح الطعام (NaCl)، ترتبط معًا بجاذبية كهروستاتيكية قوية بين الأيونات الموجبة والسالبة. تخلق هذه القوى شبكة بلورية مستقرة للغاية.
التغلب على هذه الجاذبات القوية يتطلب كمية هائلة من الطاقة الحرارية، ولهذا السبب تتمتع المركبات الأيونية عادةً بدرجات انصهار عالية جدًا.
المواد الصلبة الشبكية التساهمية: الشبكة النهائية
في المواد الصلبة الشبكية التساهمية، مثل الألماس أو الكوارتز (SiO₂)، لا تكون الذرات مجرد متجاذبة مع بعضها البعض؛ بل هي مرتبطة بشبكة مستمرة من الروابط التساهمية القوية. لا توجد جزيئات فردية لفصلها.
لصهر مثل هذه المادة، يجب أن تبدأ في كسر هذه الروابط التساهمية القوية. يتطلب هذا طاقة أكبر من أي نوع آخر من التفاعلات، مما يمنح هذه المواد أعلى درجات انصهار بين جميع المواد.
القوى بين الجزيئية (IMFs): القواعد الخاصة بالجزيئات
بالنسبة للمركبات الجزيئية (مثل الماء أو السكر أو الشمع)، لا تتعلق درجة الانصهار بكسر الروابط التساهمية داخل الجزيئات. بل تتعلق بالتغلب على قوى الجذب الأضعف بين الجزيئات. تُعرف هذه باسم القوى بين الجزيئية (IMFs).
نظرة أعمق على القوى بين الجزيئية (IMFs)
نوع وقوة القوى بين الجزيئية هو العامل الأكثر أهمية في تحديد درجة انصهار معظم المواد العضوية والجزيئية. وهي بشكل عام أضعف بكثير من الروابط الكيميائية الكاملة.
الروابط الهيدروجينية: أقوى قوة بين جزيئية
هذا نوع خاص وقوي للغاية من تفاعلات ثنائي القطب-ثنائي القطب يحدث عندما يرتبط الهيدروجين بذرة عالية السالبية الكهربائية مثل النيتروجين (N) أو الأكسجين (O) أو الفلور (F).
الجاذبية الناتجة بين الجزيئات كبيرة. الماء (H₂O) هو مثال كلاسيكي؛ تمنحه الروابط الهيدروجينية درجة انصهار أعلى بكثير (0 درجة مئوية) مما كان متوقعًا لجزيء بهذا الحجم.
تفاعلات ثنائي القطب-ثنائي القطب: عامل القطبية
الجزيئات القطبية لديها فصل دائم للشحنة، مما يخلق طرفًا موجبًا وآخر سالبًا، مثل المغناطيسات الصغيرة. هذه "الأقطاب" الجزيئية تجذب بعضها البعض.
هذه القوى أقوى من القوى بين الجزيئات غير القطبية ذات الحجم المماثل، مما يؤدي إلى درجات انصهار متوسطة.
قوى تشتت لندن (LDFs): الجاذبية الشاملة
قوى تشتت لندن هي أضعف أنواع القوى بين الجزيئية وتوجد في جميع المواد. تنشأ من التقلبات العشوائية والمؤقتة في توزيع الإلكترونات حول الجزيء، مما يخلق ثنائيات أقطاب عابرة ولحظية.
تعتمد قوة قوى تشتت لندن بشكل مباشر على حجم الجزيء (وتحديداً، عدد إلكتروناته). الجزيئات الأكبر حجمًا لديها سحب إلكترونية أكبر وأكثر "تموجًا"، مما يجعلها أكثر قابلية للاستقطاب ويؤدي إلى قوى تشتت لندن أقوى. هذا هو السبب في أن الجزيئات الكبيرة غير القطبية مثل الشمع يمكن أن تكون صلبة في درجة حرارة الغرفة.
تأثير التركيب والحجم الجزيئي
بالإضافة إلى نوع القوة، يلعب الشكل والحجم المحددان للجزيء دورًا حاسمًا في تنقيح درجة انصهاره.
الوزن الجزيئي ومساحة السطح
بالنسبة للجزيئات التي لها نفس القوة بين الجزيئية المهيمنة (على سبيل المثال، مقارنة بين جزيئين غير قطبيين)، فإن الجزيء ذو الوزن الجزيئي الأعلى سيكون له قوى تشتت لندن أقوى وبالتالي درجة انصهار أعلى. تسمح مساحة السطح الأكبر بمزيد من نقاط الاتصال بين الجزيئات، مما يقوي أيضًا قوى تشتت لندن.
التناظر الجزيئي والتراص
للتناظر تأثير عميق. يمكن للجزيئات عالية التناظر أن تتراص معًا بكفاءة أكبر وإحكام في شبكة بلورية مستقرة، مثل قطع الليغو المصنوعة جيدًا.
هذا الترتيب الكثيف والمنظم يتطلب طاقة أكبر لتفكيكه. لذلك، غالبًا ما يكون للجزيء الأكثر تناظرًا درجة انصهار أعلى بكثير من المتصاوغ الأقل تناظرًا، حتى لو كان لهما نفس الصيغة والوزن.
المزالق الشائعة التي يجب تجنبها: دور الشوائب
في سياق عملي وواقعي، أحد العوامل الأكثر شيوعًا التي تؤثر على درجة الانصهار هو نقاء العينة.
تعطيل الشبكة البلورية
الشوائب هي جزيئات غريبة لا تتناسب بدقة مع الشبكة البلورية للمادة. إنها تُدخل عيوبًا وتُضعف الهيكل العام.
نظرًا لأن الشبكة معطلة بالفعل، فإنها تتطلب طاقة أقل لتفكيكها، مما يؤدي إلى انخفاض درجة الانصهار. تُعرف هذه الظاهرة باسم انخفاض درجة الانصهار.
نطاق انصهار أوسع
عادةً ما تنصهر المادة النقية على مدى ضيق جدًا من درجات الحرارة (غالبًا أقل من 1 درجة مئوية). وجود الشوائب لا يقلل فقط من درجة الانصهار ولكنه يتسبب أيضًا في انصهار المادة على مدى أوسع وأكثر اتساعًا لدرجات الحرارة. يستخدم الكيميائيون هذه الخاصية لتقييم نقاء المركب المُصنَّع.
كيفية التنبؤ بدرجات الانصهار النسبية
عند مقارنة مادتين، اتبع هذا التسلسل الهرمي من الأسئلة لتقديم تنبؤ دقيق.
- إذا كان تركيزك الأساسي هو مقارنة أنواع المواد المختلفة: سيكون للمادة الصلبة الشبكية التساهمية (الألماس) درجة انصهار أعلى من المركب الأيوني (الملح)، والتي ستكون أعلى بكثير من المركب الجزيئي (السكر).
- إذا كان تركيزك الأساسي هو مقارنة مركبين جزيئيين: أولاً، تحقق من وجود الروابط الهيدروجينية. الجزيء الذي يمكنه تكوين روابط هيدروجينية سيكون له دائمًا تقريبًا درجة انصهار أعلى من الجزيء الذي لا يمكنه ذلك، بافتراض حجم مماثل.
- إذا كان تركيزك الأساسي هو مقارنة جزيئين غير قطبيين: الجزيء ذو الوزن الجزيئي الأعلى ومساحة السطح الأكبر سيكون له قوى تشتت لندن أقوى ودرجة انصهار أعلى.
- إذا كان تركيزك الأساسي هو مقارنة جزيئين لهما نفس الحجم ونوع القوة بين الجزيئية: الجزيء الأكثر تناظرًا الذي يمكن أن يتراص بكفاءة أكبر في الشبكة البلورية من المرجح أن يكون له درجة انصهار أعلى.
إن فهم هذه العوامل يحول درجة الانصهار من مجرد نقطة بيانات بسيطة إلى مؤشر قوي للقوى الهيكلية والأساسية للمادة.
جدول ملخص:
| العامل | التأثير على درجة الانصهار | الأمثلة الرئيسية |
|---|---|---|
| قوة الرابطة الأيونية | روابط أقوى = درجة انصهار أعلى | كلوريد الصوديوم (NaCl): 801 درجة مئوية |
| روابط الشبكة التساهمية | درجات انصهار عالية للغاية | الألماس: >3550 درجة مئوية |
| الروابط الهيدروجينية | تزيد درجة الانصهار بشكل كبير | الماء (H₂O): 0 درجة مئوية |
| حجم/وزن الجزيء | جزيئات أكبر = درجة انصهار أعلى (قوى تشتت لندن أقوى) | الشموع (وزن جزيئي عالٍ) مقابل الميثان (وزن جزيئي منخفض) |
| التناظر الجزيئي | تراص أفضل = درجة انصهار أعلى | المتصاوغات الكروية مقابل الخطية |
| النقاء | الشوائب تخفض درجة الانصهار وتوسع نطاقها | عينات نقية مقابل ملوثة |
إتقان خصائص المواد مع KINTEK
يعد فهم درجات الانصهار أمرًا بالغ الأهمية لاختيار المواد وتصنيعها ومراقبة الجودة في المختبر. سواء كنت تقوم بتطوير مركبات جديدة أو تحليل نقاء المواد، فإن امتلاك المعدات المناسبة أمر ضروري.
تتخصص KINTEK في معدات المختبرات والمواد الاستهلاكية عالية الجودة المصممة لتقديم تحليل حراري دقيق وموثوق. تساعد منتجاتنا الباحثين والمتخصصين في المختبرات على تحديد درجات الانصهار بدقة وفهم سلوك المواد.
هل أنت مستعد لتعزيز قدرات مختبرك؟ اتصل بخبرائنا اليوم
دليل مرئي
المنتجات ذات الصلة
- فرن معالجة حرارية بالفراغ وفرن صهر بالحث المغناطيسي
- فرن صهر بالحث الفراغي على نطاق المختبر
- فرن صهر القوس لنظام الدوران بالصهر بالحث الفراغي
- آلة مكبس هيدروليكي مسخن مع ألواح تسخين يدوية مدمجة للاستخدام في المختبر
- فرن صهر القوس الفراغي غير المستهلك
يسأل الناس أيضًا
- لماذا تقوم بالمعالجة الحرارية في الفراغ؟ تحقيق تشطيب سطحي مثالي وسلامة المواد
- ما هي المعالجات الحرارية الرئيسية الثلاثة؟ إتقان التخمير، والتصليد، والتطبيع
- ما هو فرن المعالجة الحرارية الفراغي؟ الدليل الشامل للمعالجة في جو متحكم به
- ما هي الأنواع الأربعة لعمليات المعالجة الحرارية؟ التخمير الرئيسي، والتطبيع، والتصليد، والتطبيع
- ما هي الأنواع المختلفة لعمليات المعالجة الحرارية للصلب؟ لتخصيص القوة والصلابة والمتانة





















