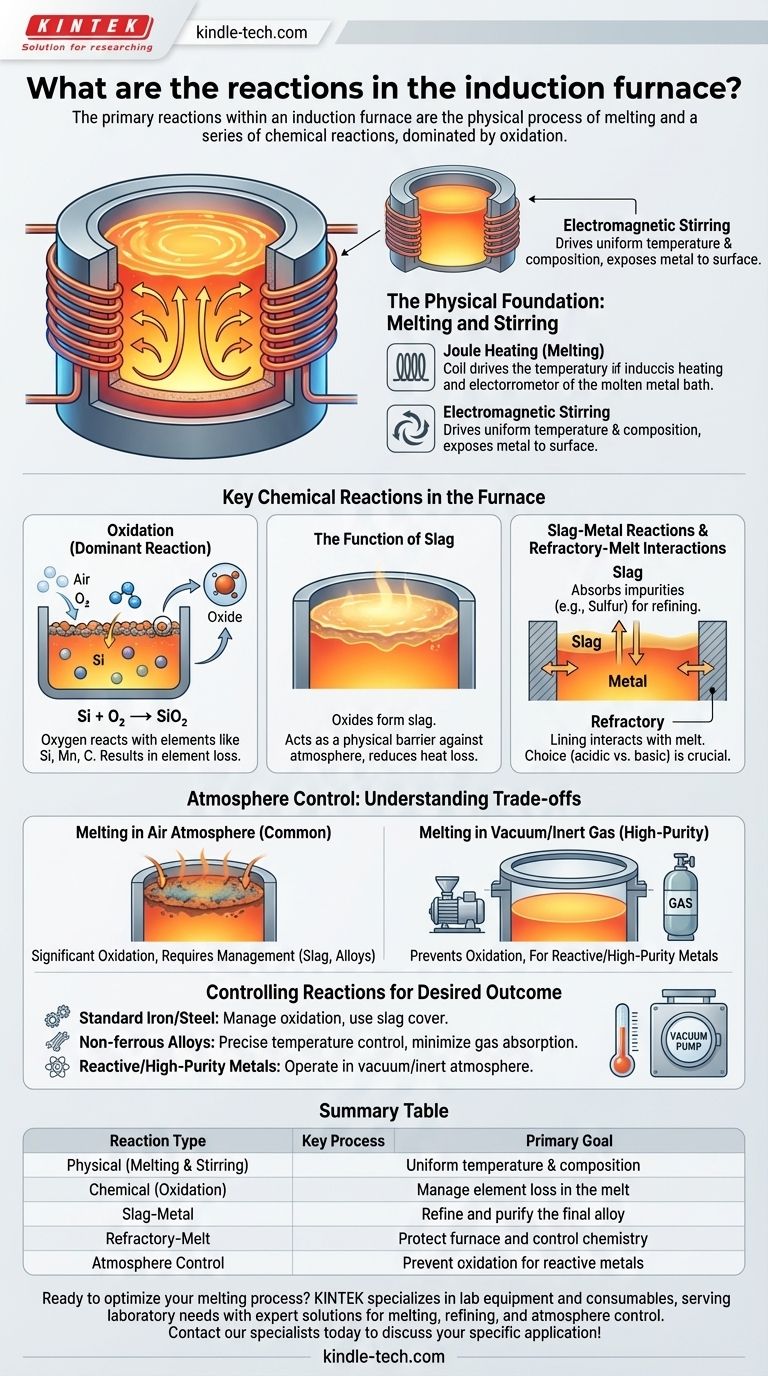
التفاعلات الأولية داخل فرن الحث هي العملية الفيزيائية للانصهار وسلسلة من التفاعلات الكيميائية، التي تهيمن عليها الأكسدة. بينما الغرض الرئيسي للفرن هو تغيير حالة المعدن من صلب إلى سائل، فإن الحرارة الشديدة والتحريك الكهرومغناطيسي يخلقان بيئة شديدة التفاعل حيث يتفاعل المعدن المنصهر مع الغلاف الجوي، وبطانة الفرن، وأي خبث موجود.
فرن الحث ليس مجرد وعاء صهر؛ إنه مفاعل معدني نشط. المفتاح هو فهم أن التحريك الكهرومغناطيسي للفرن هو المحرك الذي يدفع التفاعلات الكيميائية الحاسمة، والتي يجب التحكم فيها لتحقيق التركيب الكيميائي النهائي المطلوب للمعدن.

الأساس الفيزيائي: الانصهار والتحريك
تتأثر التفاعلات الكيميائية في فرن الحث بشكل مباشر بعمليته الفيزيائية الفريدة.
عملية الانصهار
يستخدم فرن الحث تيارًا متناوبًا قويًا في ملف نحاسي لإنشاء مجال مغناطيسي متذبذب. يحفز هذا المجال تيارات كهربائية قوية (تيارات دوامية) داخل الشحنة المعدنية، وتولد المقاومة الكهربائية للمعدن حرارة شديدة (تسخين جول)، مما يؤدي إلى انصهاره.
دور التحريك الكهرومغناطيسي
نفس القوى المغناطيسية التي تسخن المعدن تخلق أيضًا حركة تحريك قوية. تدفع هذه القوة المعدن المنصهر إلى الأعلى في المنتصف وإلى الأسفل على طول الجوانب.
هذا التحريك ليس مجرد تأثير جانبي؛ إنه محرك حاسم للعملية. فهو يضمن درجة حرارة وتركيبًا كيميائيًا موحدًا في جميع أنحاء المصهور، ولكنه يعرض باستمرار معدنًا جديدًا غير متفاعل للسطح، مما يسرع التفاعلات مع الغلاف الجوي والخبث.
التفاعلات الكيميائية الرئيسية في الفرن
بمجرد أن يصبح المعدن منصهرًا، يصبح موقعًا للعديد من التفاعلات الكيميائية الهامة.
الأكسدة: التفاعل السائد
عند الصهر في جو مفتوح، يكون الأكسجين هو العنصر الأكثر تفاعلاً. يتحد بسهولة مع العناصر الموجودة في الحمام المنصهر، خاصة تلك التي لديها قابلية عالية للأكسجين مثل السيليكون والمنغنيز والكربون (في المصهورات الحديدية).
على سبيل المثال، سيتفاعل السيليكون في مصهور الحديد مع الأكسجين من الهواء لتكوين ثاني أكسيد السيليكون:
Si + O₂ → SiO₂
تؤدي هذه الأكسدة إلى فقدان هذه العناصر من المصهور، وهو ما يجب أخذه في الاعتبار في حساب الشحنة الأولية لتلبية المواصفات الكيميائية النهائية.
وظيفة الخبث
الأكاسيد المتكونة أثناء الانصهار، مثل ثاني أكسيد السيليكون، تكون عادة أقل كثافة من المعدن المنصهر. تطفو على السطح لتشكيل طبقة سائلة تعرف باسم الخبث.
طبقة الخبث هذه ليست مجرد نفايات. إنها تعمل كحاجز مادي، يحمي المعدن المنصهر من المزيد من الأكسدة من الغلاف الجوي ويقلل من فقدان الحرارة.
تفاعلات الخبث بالمعدن
الخبث نفسه هو وسط كيميائي تفاعلي. يمكن استخدامه لتنقية المعدن عن طريق امتصاص الشوائب. على سبيل المثال، يمكن لخبث مركب بشكل صحيح أن يسحب الكبريت من مصهور الفولاذ، وهي خطوة حاسمة لتحسين خصائصه الميكانيكية.
يتم التحكم في تركيب الخبث (حمضيته أو قاعديته) بعناية لتحسين عملية التنقية هذه والتأكد من أنه لا يهاجم بطانة الفرن.
تفاعلات المواد الحرارية بالمصهور
يتم تبطين الفرن بمادة مقاومة للحرارة تسمى المادة الحرارية. هذه البطانة ليست خاملة تمامًا ويمكن أن تتفاعل مع المصهور.
يمكن أن تتآكل المادة الحرارية الحمضية (القائمة على السيليكا) بواسطة خبث قاعدي وقد تطلق كميات صغيرة من السيليكون في المصهور. على العكس من ذلك، تُستخدم المادة الحرارية القاعدية (القائمة على المغنيسيا) للمصهورات التي تتطلب خبثًا قاعديًا للتنقية. يعد اختيار المادة الحرارية قرارًا أساسيًا يحدد نوع الكيمياء التي يمكنك إجراؤها.
فهم المفاضلات: الغلاف الجوي مقابل الفراغ
تشير الإشارة إلى التشغيل في جو أو فراغ إلى خيار حاسم يتحكم بشكل مباشر في البيئة التفاعلية للفرن.
الصهر في جو هوائي
هذه هي الطريقة الأكثر شيوعًا وفعالية من حيث التكلفة. ومع ذلك، فإن المفاضلة هي الأكسدة الكبيرة. يجب على المشغلين إدارة ذلك عن طريق التحكم في درجة الحرارة، واستخدام غطاء خبث واقي، وتعديل إضافات السبائك الأولية للتعويض عن الخسائر المتوقعة.
الصهر في فراغ أو غاز خامل
بالنسبة للمعادن شديدة التفاعل مثل التيتانيوم أو السبائك الفائقة عالية النقاء، يجب أن يتم الصهر في فراغ أو جو خامل (مثل الأرجون). هذا أكثر تعقيدًا وتكلفة بكثير ولكنه الطريقة الوحيدة لمنع تفاعلات الأكسدة الضارة التي من شأنها المساس بسلامة المعدن.
التحكم في التفاعلات لتحقيق النتيجة المرجوة
يتيح لك فهم هذه التفاعلات التحكم في المنتج النهائي. سيعتمد نهجك كليًا على هدفك.
- إذا كان تركيزك الأساسي هو إنتاج مسبوكات الحديد أو الفولاذ القياسية: هدفك الرئيسي هو إدارة الأكسدة باستخدام غطاء خبث مناسب وتعديل إضافات السبائك للتعويض عن فقدان العناصر المتوقع.
- إذا كان تركيزك الأساسي هو صهر السبائك غير الحديدية عالية القيمة (مثل النحاس والألومنيوم): التحكم الدقيق في درجة الحرارة أمر بالغ الأهمية لتقليل كل من الأكسدة وامتصاص الغازات الضارة مثل الهيدروجين، مما يسبب المسامية.
- إذا كان تركيزك الأساسي هو إنتاج معادن تفاعلية أو عالية النقاء (مثل السبائك الفائقة): يجب عليك العمل في فراغ أو جو خامل لمنع أي تفاعلات كيميائية غير مرغوب فيها مع الهواء.
من خلال إتقان هذه التفاعلات، يتحول فرن الحث من مجرد مصهر إلى أداة معدنية دقيقة.
جدول ملخص:
| نوع التفاعل | العملية الرئيسية | الهدف الأساسي |
|---|---|---|
| فيزيائي | الانصهار والتحريك الكهرومغناطيسي | درجة حرارة وتركيب موحدان |
| كيميائي (أكسدة) | يتفاعل المعدن مع الأكسجين (مثل Si + O₂ → SiO₂) | إدارة فقدان العناصر في المصهور |
| خبث-معدن | يمتص الخبث الشوائب (مثل الكبريت) من المعدن | تنقية وتصفية السبيكة النهائية |
| حراري-مصهر | التفاعل بين بطانة الفرن والمصهور/الخبث | حماية الفرن والتحكم في الكيمياء |
| التحكم في الغلاف الجوي | الصهر في الهواء مقابل الفراغ/الغاز الخامل | منع الأكسدة للمعادن التفاعلية |
هل أنت مستعد لتحسين عملية الصهر الخاصة بك؟ التفاعلات في فرن الحث الخاص بك هي المفتاح لجودة منتجك النهائي واتساقه. تتخصص KINTEK في المعدات والمواد الاستهلاكية المختبرية، وتلبي احتياجات المختبرات بحلول خبراء للصهر والتنقية والتحكم في الغلاف الجوي. دع خبرتنا تساعدك على تحقيق نتائج معدنية دقيقة. اتصل بأخصائيينا اليوم لمناقشة تطبيقك المحدد!
دليل مرئي
المنتجات ذات الصلة
- فرن أنبوبي مختبري بدرجة حرارة عالية 1400 درجة مئوية مع أنبوب ألومينا
- فرن أنبوبي مختبري بدرجة حرارة عالية 1700 درجة مئوية مع أنبوب ألومينا
- فرن الضغط الساخن بالحث الفراغي 600 طن للمعالجة الحرارية والتلبيد
- فرن بوتقة 1800 درجة مئوية للمختبر
- فرن صهر بالحث الفراغي على نطاق المختبر
يسأل الناس أيضًا
- كيف يساهم فرن التفريغ ذو الأنبوب الكوارتزي في عملية تبلور الإلكتروليتات المشوبة بالفضة والليثيوم (Ag-doped Li-argyrodite)؟
- ما هو الغرض من الفرن الأنبوبي؟ التسخين الدقيق لتخليق المواد وتحليلها
- كيفية تنظيف فرن أنبوبي؟ دليل خطوة بخطوة للصيانة الآمنة والفعالة
- ما هي المواد المستخدمة في أنابيب أفران الأنابيب؟ دليل لاختيار الأنبوب المناسب لعمليتك
- كيف تعمل فرن الأنبوب؟ إتقان التحكم الدقيق في درجة الحرارة والجو المحيط



















