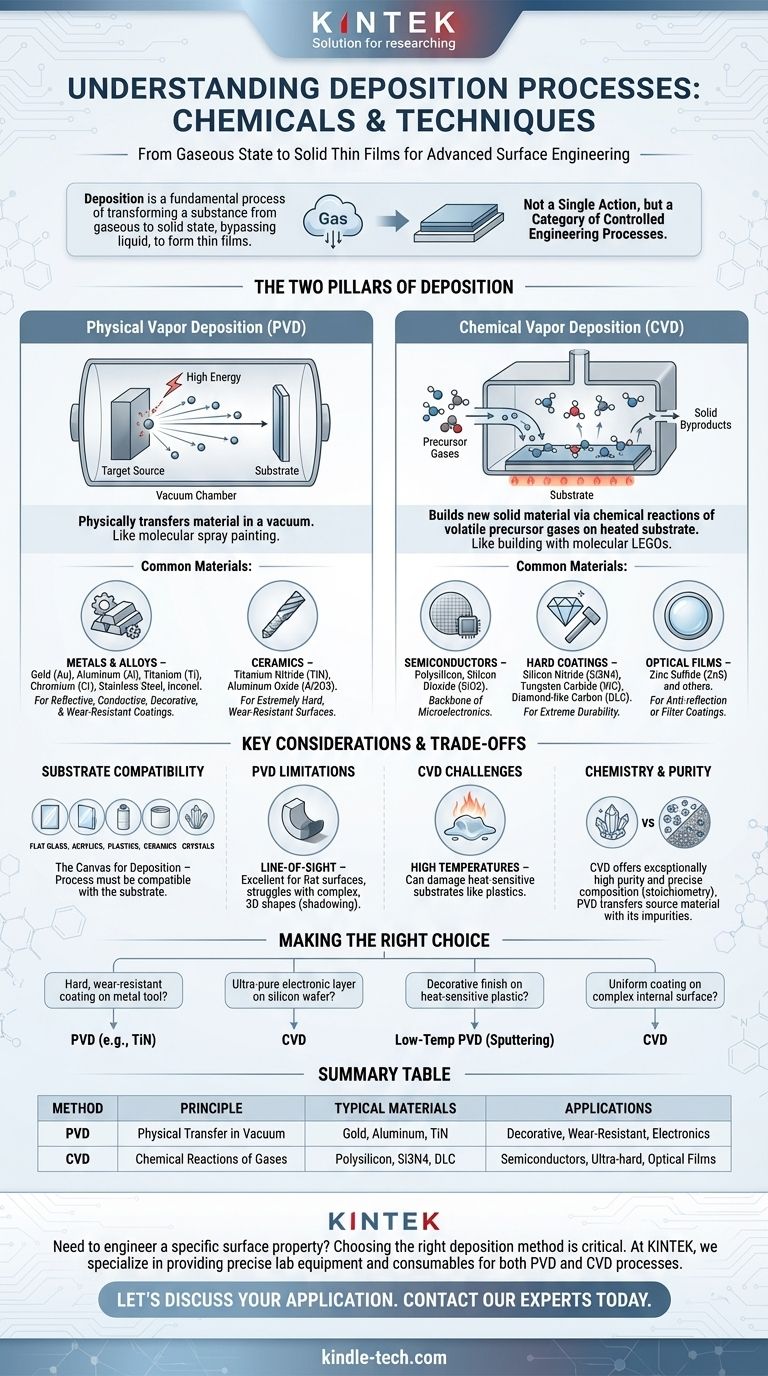
الترسيب هو عملية أساسية حيث تتحول المادة في الحالة الغازية مباشرة إلى صلبة، متجاوزة المرحلة السائلة. في حين أن الأمثلة البسيطة تشمل بخار الماء الذي يشكل الصقيع، فإن الترسيب في السياقات التقنية والصناعية يشير إلى مجموعة واسعة من العمليات المستخدمة لتطبيق أغشية رقيقة من المواد على سطح ما. يمكن ترسيب أي مادة تقريبًا، بما في ذلك المعادن مثل الذهب والألومنيوم، والسيراميك الصلب، وحتى البوليمرات مثل البلاستيك.
المفهوم الأساسي الذي يجب فهمه هو أن "الترسيب" ليس إجراءً واحدًا ولكنه فئة من العمليات الهندسية عالية التحكم. تعتمد "المادة الكيميائية" أو المادة المحددة المستخدمة كليًا على الطريقة المختارة - إما الترسيب الفيزيائي للبخار (PVD) أو الترسيب الكيميائي للبخار (CVD) - وعلى الخصائص المرغوبة للطلاء النهائي.

الركيزتان الأساسيتان للترسيب: فيزيائي مقابل كيميائي
يمكن فهم المواد التي يمكن ترسيبها بشكل أفضل عن طريق تقسيم الطرق إلى عائلتين أساسيتين. تعمل كل طريقة على مبدأ مختلف وهي مناسبة لمواد ونتائج مختلفة.
الترسيب الفيزيائي للبخار (PVD): تحريك المادة
PVD هي عملية تنقل المادة فيزيائيًا من مصدر (يسمى "الهدف") إلى الكائن المراد طلاؤه ("الركيزة"). فكر في الأمر كنوع من الرش الجزيئي الذي يحدث في فراغ.
المادة المصدر هي كتلة صلبة من الطلاء الذي ترغب في تطبيقه. تُستخدم طاقة عالية لطرد الذرات أو الجزيئات من هذا الهدف، والتي تنتقل بعد ذلك عبر الفراغ وتتكثف كفيلم صلب على سطح الركيزة.
تشمل المواد الشائعة التي يتم ترسيبها عبر PVD ما يلي:
- المعادن: الذهب (Au)، الألومنيوم (Al)، التيتانيوم (Ti)، الكروم (Cr). تُستخدم هذه للطلاءات العاكسة أو الموصلة أو الزخرفية.
- السبائك: الفولاذ المقاوم للصدأ، إنكونيل.
- السيراميك: نيتريد التيتانيوم (TiN)، أكسيد الألومنيوم (Al2O3). تخلق هذه الأسطح شديدة الصلابة والمقاومة للتآكل.
الترسيب الكيميائي للبخار (CVD): البناء بالجزيئات
CVD يختلف جوهريًا. فبدلاً من تحريك المادة الموجودة فيزيائيًا، فإنه يبني مادة صلبة جديدة مباشرة على الركيزة من خلال التفاعلات الكيميائية.
في هذه العملية، يتم إدخال واحد أو أكثر من الغازات الأولية المتطايرة إلى غرفة التفاعل. عندما تتلامس هذه الغازات مع الركيزة الساخنة، فإنها تتفاعل أو تتحلل، تاركة وراءها طبقة صلبة. إنه مثل البناء باستخدام مكعبات ليغو الجزيئية.
تشمل المواد الشائعة التي يتم نموها عبر CVD ما يلي:
- أشباه الموصلات: البولي سيليكون، ثاني أكسيد السيليكون (SiO2). هذا هو العمود الفقري لصناعة الإلكترونيات الدقيقة.
- الطلاءات الصلبة: نيتريد السيليكون (Si3N4)، كربيد التنجستن (WC)، والكربون الشبيه بالماس (DLC) لمتانة قصوى.
- الأغشية البصرية: كبريتيد الزنك (ZnS) ومواد أخرى للطلاءات المضادة للانعكاس أو المرشحة.
الركيزة: لوحة الترسيب
المادة التي يتم طلاؤها، أو الركيزة، لا تقل أهمية. يجب أن تكون عملية الترسيب متوافقة معها. المواد المذكورة في مرجعك، مثل الزجاج المسطح، الأكريليك، البلاستيك، السيراميك، والبلورات، كلها تعمل كركائز شائعة لاستقبال طبقة مترسبة.
فهم المفاضلات
يعد اختيار طريقة الترسيب مسألة موازنة المتطلبات. لا توجد عملية "أفضل" واحدة؛ فلكل منها نقاط قوة وقيود متأصلة.
PVD: قيود خط الرؤية
نظرًا لأن PVD هي عملية فيزيائية، تعتمد على خط الرؤية (مثل علبة الرش)، فهي ممتازة لطلاء الأسطح المسطحة أو المنحنية بلطف. ومع ذلك، فإنها تكافح لطلاء الأشكال المعقدة ثلاثية الأبعاد ذات الأخاديد أو الثقوب العميقة بشكل موحد، مما يخلق تأثير "الظل".
CVD: تحدي درجات الحرارة العالية
تتطلب العديد من عمليات CVD درجات حرارة عالية جدًا لدفع التفاعلات الكيميائية الضرورية. يمكن أن يؤدي ذلك بسهولة إلى إتلاف أو إذابة الركائز الحساسة للحرارة مثل البلاستيك أو بعض المعادن، مما يحد من تطبيقها.
الكيمياء والنقاء
يمكن لـ CVD إنتاج أغشية ذات نقاء عالٍ بشكل استثنائي وتركيب كيميائي دقيق (قياس العناصر المتفاعلة)، ولهذا السبب تهيمن على تصنيع أشباه الموصلات. PVD، على الرغم من أنها ممتازة للعديد من التطبيقات، تنقل بشكل أساسي مادة مصدر قد تحتوي على شوائبها الخاصة.
اتخاذ القرار الصحيح لهدفك
لاختيار العملية الصحيحة، يجب عليك أولاً تحديد هدفك للطلاء.
- إذا كان تركيزك الأساسي هو طلاء صلب ومقاوم للتآكل على أداة معدنية: PVD هو خيار قوي وشائع لتطبيق السيراميك مثل نيتريد التيتانيوم.
- إذا كان تركيزك الأساسي هو إنشاء طبقة إلكترونية فائقة النقاء على رقاقة سيليكون: CVD هو المعيار الصناعي للتحكم على المستوى الذري والدقة الكيميائية.
- إذا كان تركيزك الأساسي هو تطبيق تشطيب معدني زخرفي على جزء بلاستيكي حساس للحرارة: عملية PVD ذات درجة حرارة منخفضة مثل الرش هي الطريقة المثالية لتجنب إتلاف الركيزة.
- إذا كان تركيزك الأساسي هو طلاء سطح داخلي معقد بشكل موحد: تتمتع CVD بميزة لأن الغاز الأولي يمكن أن يتدفق ويتفاعل داخل الأشكال الهندسية المعقدة التي لا تستطيع PVD الوصول إليها.
في النهاية، الترسيب هو أداة قوية ومتعددة الاستخدامات لهندسة خصائص سطح المادة.
جدول الملخص:
| طريقة الترسيب | المبدأ | المواد الشائعة المترسبة | التطبيقات النموذجية |
|---|---|---|---|
| الترسيب الفيزيائي للبخار (PVD) | ينقل المادة فيزيائيًا في فراغ. | الذهب، الألومنيوم، نيتريد التيتانيوم (TiN) | الطلاءات الزخرفية، الأسطح المقاومة للتآكل، الإلكترونيات |
| الترسيب الكيميائي للبخار (CVD) | يبني المادة عبر التفاعلات الكيميائية للغازات. | البولي سيليكون، نيتريد السيليكون (Si3N4)، الكربون الشبيه بالماس (DLC) | أجهزة أشباه الموصلات، الطلاءات فائقة الصلابة، الأغشية البصرية |
هل تحتاج إلى هندسة خاصية سطحية محددة؟
يعد اختيار طريقة الترسيب والمادة المناسبة أمرًا بالغ الأهمية لنجاح مشروعك. في KINTEK، نحن متخصصون في توفير معدات المختبرات والمواد الاستهلاكية الدقيقة اللازمة لكل من عمليات PVD و CVD. سواء كنت تقوم بتطوير أدوات مقاومة للتآكل، أو أشباه موصلات متقدمة، أو طلاءات بصرية متخصصة، يمكن لخبرتنا أن تساعدك في تحقيق نتائج متفوقة.
دعنا نناقش تطبيقك. اتصل بخبرائنا اليوم للعثور على حل الترسيب المثالي لاحتياجات مختبرك.
دليل مرئي
المنتجات ذات الصلة
- معدات ترسيب البخار الكيميائي CVD نظام غرفة انزلاق فرن أنبوبي PECVD مع جهاز تسييل الغاز السائل آلة PECVD
- معدات ترسيب البخار الكيميائي المعزز بالبلازما الدوارة المائلة فرن أنبوبي آلة
- نظام ترسيب بخار كيميائي معزز بالبلازما بترددات الراديو RF PECVD
- نظام معدات ترسيب البخار الكيميائي متعدد الاستخدامات ذو الأنبوب الحراري المصنوع حسب الطلب للعملاء
- فرن أنبوبي ترسيب بخار كيميائي ذو حجرة مقسمة مع نظام محطة تفريغ معدات آلة ترسيب بخار كيميائي
يسأل الناس أيضًا
- ما هي خطوات عملية الترسيب الكيميائي للبخار (CVD)؟ دليل لترسيب الأغشية الرقيقة الدقيقة
- ما هو ترسيب البخار الكيميائي المعزز بالبلازما (PECVD) في أشباه الموصلات؟ تمكين ترسيب الأغشية الرقيقة في درجات حرارة منخفضة للدوائر المتكاملة
- ما هي ألوان الماس المصنوع بتقنية CVD؟ فهم العملية من اللون البني إلى الجمال عديم اللون
- ما هي عملية الترسيب بالتبخير الفراغي؟ إتقان طلاء الأغشية الرقيقة بالترسيب الكيميائي للبخار (CVD) والترسيب الفيزيائي للبخار (PVD)
- ما هو الفرق بين الترسيب الكيميائي للبخار المعزز بالبلازما (PECVD) والترسيب الكيميائي للبخار (CVD)؟ اكتشف طريقة الترسيب المناسبة للأغشية الرقيقة



















