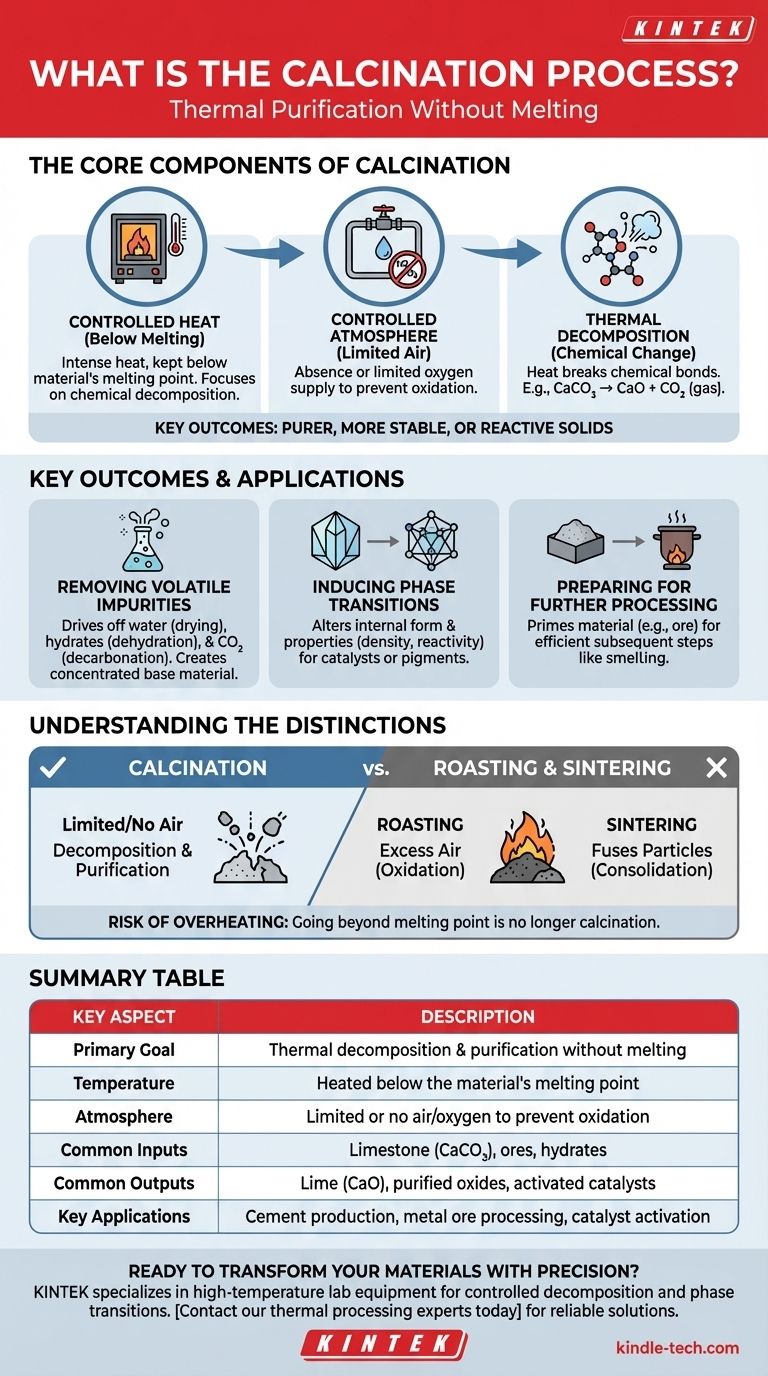
في جوهرها، التكليس هو عملية تنقية حرارية. يتضمن تسخين مادة صلبة إلى درجة حرارة عالية، ولكن أقل من درجة انصهارها، في جو متحكم به مع القليل من الهواء أو بدونه. يؤدي هذا التسخين الدقيق إلى طرد المواد المتطايرة مثل الماء وثاني أكسيد الكربون، أو يحفز التحلل الكيميائي، أو يغير التركيب البلوري الداخلي للمادة، مما ينتج عنه مادة صلبة أكثر نقاءً أو استقرارًا أو تفاعلية.
الهدف الأساسي من التكليس ليس صهر المادة، بل تحويلها. من خلال التحكم الدقيق في الحرارة والجو، يمكنك إزالة المكونات غير المرغوب فيها بشكل انتقائي أو تغيير خصائص المادة دون تغيير حالتها الصلبة.

كيف يعمل التكليس بشكل أساسي
لفهم التكليس، من الضروري فهم مكوناته الأساسية الثلاثة: الحرارة المتحكم بها، والجو المحدد، والتغيرات الكيميائية الناتجة.
دور الحرارة (أقل من درجة الانصهار)
المعلمة الأكثر أهمية في التكليس هي درجة الحرارة. يتم تسخين المادة بشدة، ولكن يتم دائمًا إبقاؤها أقل من درجة انصهارها.
يضمن هذا أن تركز العملية على التحلل الكيميائي بدلاً من تغيير الحالة (من صلب إلى سائل). يسمح ذلك بالتحلل المتحكم فيه للمركبات داخل التركيب الصلب.
الجو المتحكم به
عادة ما يتم إجراء التكليس في غياب الهواء (الأكسجين) أو مع إمداد محدود منه.
هذا تمييز حاسم. عن طريق الحد من الأكسجين، فإنك تمنع الأكسدة أو الاحتراق. الهدف هو تحليل المادة بالحرارة وحدها (التحلل الحراري)، وليس تفاعلها مع الأكسجين.
الهدف الأساسي: التحلل
توفر الحرارة المطبقة أثناء التكليس الطاقة اللازمة لكسر الروابط الكيميائية. يُعرف هذا باسم التحلل الحراري.
مثال كلاسيكي هو إنتاج الجير من الحجر الجيري. عندما يتم تكليس الحجر الجيري (كربونات الكالسيوم، CaCO₃)، فإنه يتحلل إلى جير (أكسيد الكالسيوم، CaO) ويطلق غاز ثاني أكسيد الكربون (CO₂)، وهو مكون متطاير.
النتائج الرئيسية للتكليس
اعتمادًا على المادة والهدف، يحقق التكليس عدة نتائج محددة.
إزالة الشوائب المتطايرة
التطبيق الأكثر شيوعًا هو التنقية. تدفع العملية المواد المتطايرة، وهي المكونات التي تتحول بسهولة إلى غاز عند تسخينها.
يشمل ذلك الماء المرتبط فيزيائيًا (التجفيف)، والماء المرتبط كيميائيًا في الهيدرات (نزع الماء)، وثاني أكسيد الكربون من خامات الكربونات (نزع الكربنة). والنتيجة هي نسخة أكثر تركيزًا ونقاءً من المادة الأساسية.
تحفيز التحولات الطورية
في بعض الأحيان، لا يكون الهدف هو إزالة أي شيء بل تغيير الشكل الداخلي للمادة.
يمكن أن يحفز التكليس تحولًا طوريًا، مما يغير التركيب البلوري للمادة. يمكن أن يغير هذا خصائصها، مثل الصلابة أو الكثافة أو التفاعلية، مما يجعلها مناسبة لتطبيق معين مثل محفز أو صبغة.
إعداد المواد لمزيد من المعالجة
في كثير من الأحيان، يكون التكليس خطوة تحضيرية. من خلال إزالة الشوائب وإنشاء مادة أكثر تفاعلية (مثل أكسيد)، يتم تجهيز المادة لعملية لاحقة.
على سبيل المثال، يمكن أن يؤدي تكليس الخام إلى جعل الاستخلاص اللاحق للمعدن النهائي عن طريق الصهر أكثر كفاءة وأقل استهلاكًا للطاقة.
فهم المفاضلات والفروق
غالبًا ما يتم الخلط بين التكليس والعمليات الحرارية الأخرى. يعد فهم الاختلافات أمرًا أساسيًا لفهم وظيفته المحددة.
التكليس مقابل التحميص
التحميص هو عملية حرارية أخرى، ولكنه يتم بوجود فائض من الهواء. هدفه هو التسبب في الأكسدة عن قصد. على سبيل المثال، تحويل خام كبريتيد معدني إلى أكسيد معدني. في المقابل، يتجنب التكليس بنشاط الأكسدة.
التكليس مقابل التلبيد
يستخدم التلبيد أيضًا الحرارة دون درجة الانصهار، لكن هدفه مختلف تمامًا. يهدف التلبيد إلى صهر الجسيمات الصغيرة معًا لزيادة كثافة المادة وقوتها. التكليس ينقي ويحلل؛ التلبيد يدمج. في العديد من مسارات العمل الصناعية، يتم إجراء التكليس أولاً، يليه التلبيد.
خطر ارتفاع درجة الحرارة
التحكم في درجة الحرارة أمر بالغ الأهمية. إذا تم تسخين المادة إلى ما وراء نقطة انصهارها، فإن العملية لم تعد تكليسًا. تصبح انصهارًا أو تلبيدًا، وهو ما قد يكون غير مرغوب فيه ويؤدي إلى منتج نهائي مختلف تمامًا، وغالبًا ما يكون غير قابل للاستخدام.
اتخاذ الخيار الصحيح لهدفك
التكليس أداة دقيقة تستخدم لتحقيق تحولات مادية محددة. هدفك يحدد تطبيقه.
- إذا كان تركيزك الأساسي هو تنقية الخام: استخدم التكليس لطرد الماء والكربونات، مما يخلق أكسيدًا أكثر تركيزًا قبل الصهر.
- إذا كان تركيزك الأساسي هو إنتاج الأسمنت: تكليس الحجر الجيري لإنتاج الجير هو الخطوة الأولى الأساسية وغير القابلة للتفاوض في العملية.
- إذا كان تركيزك الأساسي هو تنشيط محفز: استخدم التكليس لتحقيق التركيب البلوري المثالي ومساحة السطح اللازمة للتفاعلية الكيميائية العالية.
في نهاية المطاف، التكليس هو أسلوب أساسي في علم المواد لتعديل التركيب الكيميائي والهيكل للمادة عن قصد من خلال الحرارة.
جدول الملخص:
| الجانب الرئيسي | الوصف |
|---|---|
| الهدف الأساسي | التحلل الحراري والتنقية دون انصهار |
| درجة الحرارة | التسخين أقل من درجة انصهار المادة |
| الجو | هواء/أكسجين محدود أو معدوم لمنع الأكسدة |
| المدخلات الشائعة | الحجر الجيري (CaCO₃)، الخامات، الهيدرات |
| المخرجات الشائعة | الجير (CaO)، الأكاسيد النقية، المحفزات المنشطة |
| التطبيقات الرئيسية | إنتاج الأسمنت، معالجة خامات المعادن، تنشيط المحفزات |
هل أنت مستعد لتحويل موادك بدقة؟
تعتبر عملية التكليس حاسمة لتنقية الخامات، وإنتاج الأسمنت، وتنشيط المحفزات. تتخصص KINTEK في معدات المختبرات ذات درجات الحرارة العالية اللازمة لتحقيق هذه التحولات الحرارية الدقيقة بموثوقية وكفاءة.
سواء كنت تقوم بمعالجة المعادن أو تطوير مواد متقدمة، فإن خبرتنا في أفران المختبرات والمواد الاستهلاكية تضمن حصولك على الأدوات المناسبة للتحلل المتحكم به والتحولات الطورية.
اتصل بخبرائنا في المعالجة الحرارية اليوم لمناقشة كيف يمكن لحلول KINTEK تحسين سير عمل التكليس الخاص بك وتعزيز نتائج المواد لديك.
دليل مرئي
المنتجات ذات الصلة
- فرن الفرن الكتم 1400 درجة مئوية للمختبر
- فرن بوتقة 1800 درجة مئوية للمختبر
- فرن الفرن الصهري للمختبر ذو الرفع السفلي
- فرن بوتقة 1700 درجة مئوية للمختبر
- فرن أنبوبي مختبري بدرجة حرارة عالية 1400 درجة مئوية مع أنبوب ألومينا
يسأل الناس أيضًا
- ما هو الفرق بين فرن الكيبل (muffle furnace) والفرن الهوائي (air oven)؟ اختر الأداة المناسبة لعمليتك الحرارية
- ما الفرق بين فرن الكتمان والفرن الأنبوبي؟ دليل لاختيار فرن المختبر المناسب
- ما الفرق بين فرن الصهر والحاضنة؟ اختر الأداة المناسبة لمختبرك
- كيف يتم تحديد محتوى الرماد في فرن التجفيف؟ إتقان طريقة التحليل الوزني
- ما هو الغرض من فرن الكيور (Muffle Furnace)؟ تحقيق معالجة عالية الحرارة وخالية من الملوثات



















